
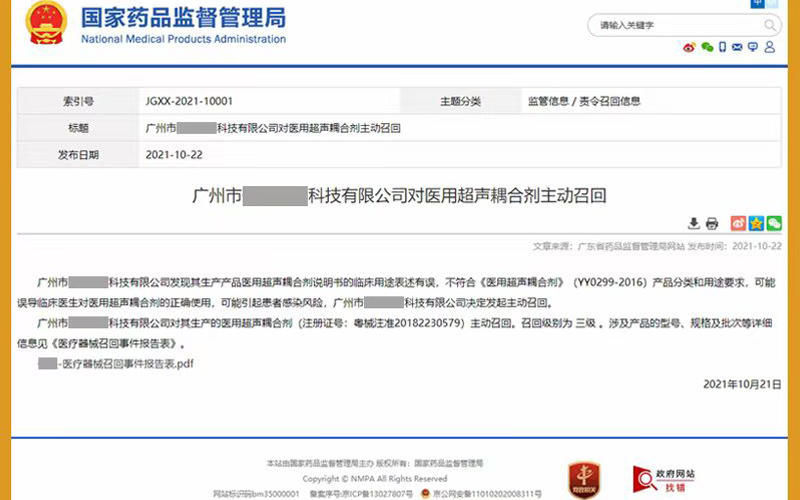
2021年10月22日,廣州市某醫(yī)療科技有限公司收到廣東省藥品監(jiān)督管理局的告誠信,發(fā)現(xiàn)其生產(chǎn)產(chǎn)品醫(yī)用超聲耦合劑說明書的臨床用途表述有誤,不符合《醫(yī)用超聲耦合劑》(YY0299-2016)產(chǎn)品分類和用途要求,可能誤導(dǎo)臨床醫(yī)生對醫(yī)用超聲耦合劑的正確使用,可能引起患者感染風(fēng)險(xiǎn),廣州市某醫(yī)療科技有限公司決定召回這批耦合劑。
從這次召回事件我們可以感受到廣東省藥監(jiān)局對耦合劑使用規(guī)范的整頓決心,早在2016年1月26日,國家食品藥品監(jiān)督管理總局就發(fā)布了醫(yī)藥行業(yè)新標(biāo)準(zhǔn)-《醫(yī)用超聲耦合劑》(YY0299-2016),并于2018年1月1日正式實(shí)施,該標(biāo)準(zhǔn)將醫(yī)用超聲耦合劑分為無菌型和非無菌型,其中非無菌型又分為消毒型和非消毒型。非無菌型主要用于在完好皮膚上進(jìn)行的超聲診斷、治療操作。無菌型用于術(shù)中超聲、穿刺活檢等在創(chuàng)口和非完好皮膚上進(jìn)行的超聲診斷、治療操作;經(jīng)食管、陰道、直腸等接觸完好粘膜的超聲診斷、治療操作和對嬰兒進(jìn)行的超聲診斷、治療操作。
在2021年01月05日,國家藥品監(jiān)督管理局又發(fā)布了關(guān)于進(jìn)一步規(guī)范醫(yī)用超聲耦合劑說明書等有關(guān)內(nèi)容的公告(2020年第143號(hào)),對醫(yī)用超聲耦合劑的使用進(jìn)行進(jìn)一步的規(guī)范說明,具體如下圖所示:

這次廣州市某醫(yī)療科技有限公司耦合劑被召回的事件實(shí)際上也是給每個(gè)耦合劑生產(chǎn)廠家、代理商和采購商敲了警鐘,在前幾年不少耦合劑生產(chǎn)廠家對用于腔道粘膜的超聲檢查沒有嚴(yán)格的規(guī)范說明,并且沒有對代理商和采購商進(jìn)行正確引導(dǎo),導(dǎo)致他們把非無菌型的耦合劑銷售給需要進(jìn)行腔道粘膜檢查的科室,這不僅增加了醫(yī)院的感染風(fēng)險(xiǎn)概率,與國家藥品監(jiān)督管理局的規(guī)范要求也是背道而馳的。
為了響應(yīng)國家藥品監(jiān)督管理局的規(guī)范要求,減少院感事件發(fā)生,凡是使用于腔道粘膜上的都應(yīng)當(dāng)采用醫(yī)用無菌耦合劑,普通的醫(yī)用超聲耦合劑和醫(yī)用消毒超聲耦合劑等非無菌型耦合劑不可再使用于腔道粘膜上的超聲診斷和治療操作。
平創(chuàng)醫(yī)療生產(chǎn)的平之創(chuàng)®耦合劑系列符合《醫(yī)用超聲耦合劑》(YY0299-2016)標(biāo)準(zhǔn),選擇平之創(chuàng)®耦合劑可以有效避免因產(chǎn)品不符合標(biāo)準(zhǔn)而造成損失。


佛山市平創(chuàng)醫(yī)療科技有限公司 備案號(hào):粵ICP備16092276號(hào)
互聯(lián)網(wǎng)藥品信息服務(wù)資格證書:(粵)-非經(jīng)營性-2021-0350
電話:400-962-9277 郵箱:oc@pingchuangyl.com
廠址:佛山市順德區(qū)北滘鎮(zhèn)順江居委會(huì)林港創(chuàng)業(yè)園華業(yè)路3號(hào)
營銷中心:廣州市番禺區(qū)漢溪長隆時(shí)代E-PARK A1棟
 粵公網(wǎng)安備 44060602002038號(hào)
粵公網(wǎng)安備 44060602002038號(hào)
 手機(jī)官網(wǎng)
手機(jī)官網(wǎng)